Lebende Medikamente
Die stärkste Waffe gegen Krebs tragen wir in uns. Doch nicht immer arbeitet unser Immunsystem zuverlässig. Krebszellen können sich tarnen und werden nicht als Feind erkannt; oder ihre Botenstoffe hemmen die Aktivität von Immunzellen. Immunzellen aber lassen sich nicht so leicht austricksen, wie die innovative CAR-T-Zell-Immuntherapie eindrucksvoll belegt.
Text: Ingrid Kupczik, Fotos: Axel Kirchhof
DIE VISION: DAUERHAFTE IMMUNREAKTION GEGEN KREBSZELLEN
Wissen: Immunzellen attackieren Krebszellen
Forschen: Synthetische Rezeptoren optimieren den Angriff
Heilen: Neue Hoffnung für schwerkranke Patient:innen
Der Mittvierziger, dem Prof. Dr. Francis Ayuk kürzlich auf dem UKE-Gelände begegnete, war eilig zu Fuß unterwegs, er hatte einen Routine-Check beim Kardiologen wegen einer länger zurückliegenden Herzklappen-OP. Seine schwere Krebserkrankung, die ihn vor drei Jahren beinahe das Leben gekostet hätte, liefert keinen Grund mehr zum Besuch im UKE. Der Mann steht mitten im Leben, arbeitet längst wieder. Und er gehört zu den ersten von mittlerweile rund 80 Patient:innen mit Krebserkrankungen des Bluts oder Lymphsystems, die seit 2019 im UKE mit der CAR-T-Zelltherapie behandelt wurden. Weder Bestrahlung noch wiederholte Chemotherapien hatten das aggressive B-Zell-Lymphom des Hamburgers zurückdrängen können. Dennoch gilt er heute als geheilt. Prof. Ayuk, der ihn behandelt hat, staunt nach wie vor über die Wirkung der innovativen Therapie: „Sie erreicht bei Patient:innen Erfolge, die wir uns nicht hätten erträumen können“, sagt der Leiter des CAR-T-Zellprogramms der Interdisziplinären Klinik und Poliklinik für Stammzelltransplantation.
Enormes Potenzial
Das Verfahren birgt großes Behandlungspotenzial. „Man kann den CAR für alle Menschen nutzen, die unter der gleichen Krankheit leiden. Dadurch ist eine breite Anwendung möglich“, erläutert Prof. Dr. Boris Fehse, wissenschaftlicher Laborleiter der Klinik für Stammzelltransplantation, wo die klinische Anwendung von einem umfangreichen Forschungsprogramm begleitet wird. „Gleichzeitig handelt es sich um eine höchst personalisierte Medizin.“ Alle Patient:innen werden mit den eigenen, gentechnisch „getunten“ T-Zellen behandelt. Dafür wird ihnen zunächst Blut entnommen, die weißen Blutkörperchen werden herausgesammelt, die verbleibenden Blutbestandteile in den Körper zurückgeleitet. Anschließend werden die T-Zellen gefiltert und mit einem zugelassenen CAR ausgestattet; nun können sie den Antigenrezeptor auf ihrer Oberfläche selbst herstellen. Diese CAR-T-Zellen werden den Patient:innen zurückinfundiert* und vermehren sich im Körper.



„Die CAR-T-Therapien sind zum Teil mit völlig neuen Risiken und Nebenwirkungen verbunden – ihr Erfolg erfordert daher die enge Zusammenarbeit in einem großen Team“, erläutert Prof. Ayuk. Beim Aufbau des klinischen CAR-T-Programms hat er ein Netzwerk von Kolleg:innen verschiedener Fachrichtungen wie der Transfusionsmedizin, Intensivmedizin, Neurologie und Hämatologie/Onkologie etabliert, damit die Patient:innen schnell und optimal versorgt werden. „Wir sind auf mögliche Nebenwirkungen sehr gut vorbereitet“, betont er.
Internationale Erfolge
Spektakuläre Therapieerfolge geben Anlass zu dieser Hoffnung: Doug Olson und Bill Ludwig, die vor zehn Jahren mit Mitte 60 an der University of Pennsylvania eine CAR-T-Zelltherapie gegen ihren Blutkrebs im Endstadium erhielten, sind bis heute krebsfrei. Die Amerikanerin Emily Whitehead war fünf, als sie an einer aggressiven Variante der Akuten Lymphatischen Leukämie (ALL) erkrankte. Zwei Jahre Chemotherapie konnten dem todkranken Mädchen nicht helfen; als erstes Kind weltweit erhielt Emily die innovative Immuntherapie. Im April veröffentlichte die 17-Jährige, wie jedes Jahr um diese Zeit, ein neues Foto auf ihrer Homepage. Sie hält darauf eine Tafel: 10 years cancer free!
Seit 20 Jahren für ein gemeinsames Ziel
Francis Ayuk und Boris Fehse arbeiten seit rund 20 Jahren zusammen, seit dem Start der CAR-T-Zelltherapie im UKE intensiver als je zuvor. Gemeinsam haben sie Dutzende wissenschaftliche Arbeiten in internationalen Journalen veröffentlicht; einige ihrer jüngsten Ideen zu neuen CARs hat sich das UKE für Patentanmeldungen gesichert. „Die enge Verzahnung von Forschung und Klinik ist essenziell für den Behandlungserfolg“, sagt Fehse. Und für die Klärung offener Fragen: Warum profitieren nicht alle Patient:innen von CAR? Wie lassen sich die klinisch verfügbaren CAR-Produkte verbessern? Wie muss ein CAR beschaffen sein, um auch solide Tumore* wie Brust- oder Darmkrebs zu knacken? Für welche Erkrankungen jenseits von Krebs eignet sich das Verfahren? Die Entwicklung neuer CAR-Effektorzellen ist eines der großen Ziele der klinikbegleitenden Forschung, die vom Förderverein für Knochenmarktransplantation in Hamburg, von der Deutschen Krebshilfe sowie der Barbara und Wilfried Mohr-Stiftung finanziell gefördert wird.
Weitere Ziele liegen greifbar nahe: die Herstellung der CAR-T-Zellen direkt vor Ort. Bisher werden die T-Zellen an einen Hersteller von zugelassenen kommerziellen CARs, zumeist in den USA, geschickt, dort präpariert und zurückgesandt. „Das kostet Zeit, in der sich der Zustand der Patient:innen oft verschlechtert“, so Prof. Fehse. Außerdem arbeiten Fehse und Ayuk an Konzepten für CAR-basierte Therapien, die unabhängig von patienteneigenen Zellen sofort verfügbar wären. Beide Ansätze würden eine schnellere Behandlung erlauben und auch Behandlungskosten deutlich senken.
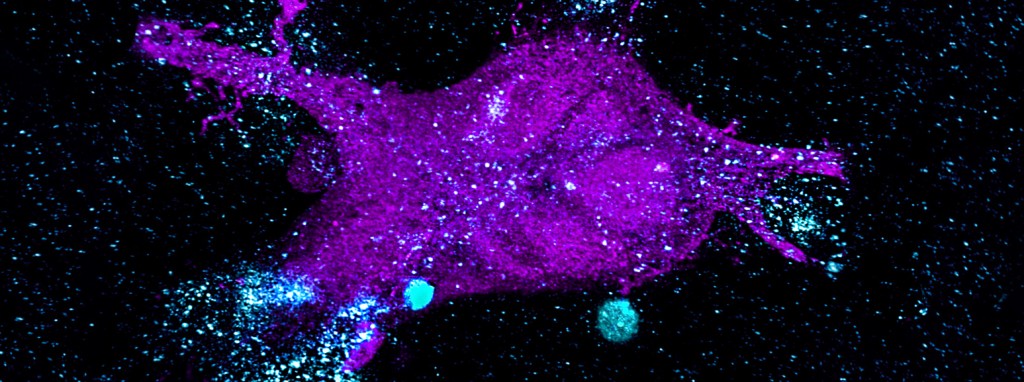
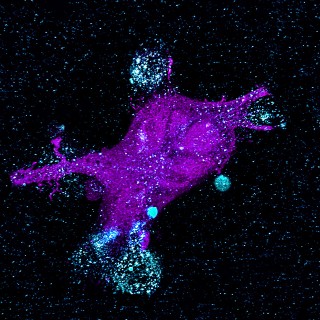
Attacke im Zeitraffer
Die blau gefärbten, mit dem CAR aktivierten T-Zellen greifen die Krebszellen an und zerstören diese. Eindrucksvolle Bilder, aufgenommen durchs Mikroskop.
T-Zellen
sind weiße Blutkörperchen, die zur adaptiven („lernenden“) Immunabwehr gehören. Sie erkennen fremde Strukturen auf Körperzellen, etwa Viren oder krebsbedingte Veränderungen, und zerstören sie. CAR perfektioniert die Freund-Feind-Erkennung der T-Zellen. Das Kürzel steht für Chimärer Antigen-Rezeptor, ein gentechnisch hergestelltes Molekül, das auf eine spezifische Zielstruktur (Antigen) auf der Krebszelle gerichtet ist. Wenn die genetische Information des CAR in das Erbgut einer T-Zelle integriert wird, wird diese in die Lage versetzt, bestimmte Krebszellen zu erkennen und auszuschalten.
Mehr Informationen?
Besuchen Sie die Klinikseite www.uke.de/forschung-stammzellen
Vorheriger Beitrag:
Die Medizin der Zukunft beginnt heute
Nächster Beitrag:
Die Pille aus dem Drucker
Übersichtseite
Zurück zur Übersicht





_special_template_hero_image.jpg)
_spezial_template_hero_mobil_quadratisch.jpg)



